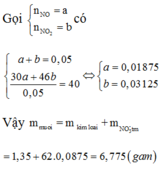Cho 1,35 gam hỗn hợp A gồm Cu, Mg, Al tác dụng với H2SO4 đặc nóng dư được 0,784 lít khí SO2 (đktc,spk duy nhất). Tổng khối lượng muối sunfat sinh ra là?

Những câu hỏi liên quan
Cho 27,25 gam hỗn hợp X gồm Mg, Al, Fe, Cu tác dụng với O2 thu được m gam hỗn hợp chất rắn Y. Cho toàn bộ Y tác dụng với dung dịch H2SO4 đặc, nóng, thu được dung dịch Z (chứa 5 muối, với tổng khối lượng muối là 96,85 (gam) và 10,64 lít (đktc) khí SO2 duy nhất. Giá trị của m là A. 38,85. B. 31,25. C. 34,85. D. 20,45.
Đọc tiếp
Cho 27,25 gam hỗn hợp X gồm Mg, Al, Fe, Cu tác dụng với O2 thu được m gam hỗn hợp chất rắn Y. Cho toàn bộ Y tác dụng với dung dịch H2SO4 đặc, nóng, thu được dung dịch Z (chứa 5 muối, với tổng khối lượng muối là 96,85 (gam) và 10,64 lít (đktc) khí SO2 duy nhất. Giá trị của m là
A. 38,85.
B. 31,25.
C. 34,85.
D. 20,45.
Cho 3,35 gam hỗn hợp gồm Mg, Al, Cu tác dụng hoàn toàn với dung dịch H2SO4 đặc nóng, dư được 2,8 lít khí SO2 (đktc). Khi đốt 3,35 gam hỗn hợp trên trong khí Clo dư thì khối lượng muối clorua thu được là
nSO2 = \(\dfrac{2,8}{22,4}\)=0,125 mol
S+6 + 2e → S+4
0,25<-----0,125
=> Số mol e do 3,35 gam hỗn hợp kim loại nhường là 0,25 mol.
Xét phản ứng với Clo
Kim loại + Cl2 → Muối clorua
Có 3,35 gam kim loại phản ứng nên số mol e kim loại nhường cũng là 0,25 mol
Cl20 + 2e → 2Cl-1
0,25 --> 0,25
=> nCl-1 trong muối clorua = 0,25 mol
<=> mCl-1 = 0,25.35,5 = 8,875 gam.
mMuối = mKim loại + mCl-1 = 3,35 + 8,875 = 12,225 gam.
Đúng 2
Bình luận (0)
Cho 1,35 gam hỗn hợp gồm Cu, Mg, Al tác dụng với dung dịch HNO3 dư, thu được 1,12 lít (đktc) hỗn hợp khí NO và NO2 có tỉ khối so với hiđro bằng 20. Tổng khối lượng muối nitrat sinh ra là A. 66,75 gam. B. 33,35 gam. C. 6,775 gam. D. 3,335 gam.
Đọc tiếp
Cho 1,35 gam hỗn hợp gồm Cu, Mg, Al tác dụng với dung dịch HNO3 dư, thu được 1,12 lít (đktc) hỗn hợp khí NO và NO2 có tỉ khối so với hiđro bằng 20. Tổng khối lượng muối nitrat sinh ra là
A. 66,75 gam.
B. 33,35 gam.
C. 6,775 gam.
D. 3,335 gam.
Đáp án C
Gọi n N O = a n N O 2 = b
Có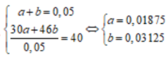
Vậy
m m u ố i = m k i m l o ạ i + m N O 3 -
=1 1,35+62.0,0875 = 6,775 (gam)
Đúng 0
Bình luận (0)
Cho 1,35 gam hỗn hợp gồm Cu, Mg, Al tác dụng với dung dịch HNO3 dư, thu được 1,12 lít (đktc) hỗn hợp khí NO và NO2 có tỉ khối so với hiđro bằng 20. Tổng khối lượng muối nitrat sinh ra là A. 66,75 gam. B. 33,35 gam. C. 6,775 gam. D. 3,335 gam.
Đọc tiếp
Cho 1,35 gam hỗn hợp gồm Cu, Mg, Al tác dụng với dung dịch HNO3 dư, thu được 1,12 lít (đktc) hỗn hợp khí NO và NO2 có tỉ khối so với hiđro bằng 20. Tổng khối lượng muối nitrat sinh ra là
A. 66,75 gam.
B. 33,35 gam.
C. 6,775 gam.
D. 3,335 gam.
Câu 2: Cho 1,35 gam hỗn hợp A gồm Cu, Mg, Al tác dụng với HNO3 dư được 1,12 lít NO và NO2 có khối lượng mol trung bình là 42,8. Biết thể tích khí đo ở đktc. Tổng khối lượng muối nitrat sinh ra là?
Theo gt ta có: $n_{NO}=0,01(mol);n_{NO_2}=0,04(mol)$
Bảo toàn e ta có: $n_{e}=n_{NO_3^-/trongmuoi}=0,07(mol)$
$\Rightarrow m_{muoi}=1,35+62.0,07=5,69(g)$
Đúng 1
Bình luận (0)
\(n_{No}=a\left(mol\right),n_{NO_2}=b\left(mol\right)\)
\(\Rightarrow a+b=0.05\)
\(m=30a+46b=0.05\cdot42.8=2.14\left(g\right)\)
\(\Rightarrow a=0.01,b=0.04\)
\(m_{Muối}=m_{kl}+m_{NO_3^-}=1.35+62\cdot\left(0.01\cdot3+0.04\right)=5.69\left(g\right)\)
Đúng 1
Bình luận (0)
Cho 1,35 gam hỗn hợp Cu, Mg, Al tác dụng với HNO3 dư được 896ml hỗn hợp gồm NO và NO2 có M = 42 . Tính tổng khối lượng muối nitrat sinh ra (khí ở đktc).
Gọi \(n_{NO} = a ; n_{NO_2} = b\)
Ta có :
\(a + b = \dfrac{896}{1000.22,4} = 0,04\\ 30a + 46b = 0,04.42\)
Suy ra a = 0,01 ; b = 0,03
Giả sử không có muối amoni tạo thành.
\(n_{NO_3^-} = n_{e\ trao\ đổi} = 3n_{NO} + n_{NO_2} = 0,06(mol)\)
\(m_{muối} = m_{kim\ loại} + m_{NO_3^-} = 1,35 + 0,06.62 = 5,07(gam)\)
Đúng 1
Bình luận (0)
Cho 17,2 gam hỗn hợp kim loại gồm Fe cà Cu tác dụng vừa đủ với dd H2SO4 đặc nóng dư thu được 6,72 lít khí SO2 (đktc) là sản phẩm khử duy nhất. Tính khối lượng mỗi muối và khối lượng dung dịch H2SO4 80% phản ứng
`2Fe + 6H_2 SO_[4(đ,n)] -> Fe_2(SO_4)_3 + 3SO_2 \uparrow + 6H_2 O`
`0,05` `0,15` `0,025` `(mol)`
`Cu + 2H_2 SO_[4(đ,n)] -> CuSO_4 + SO_2 \uparrow + 2H_2 O`
`0,225` `0,45` `0,225` `(mol)`
`n_[SO_2]=[6,72]/[22,4]=0,3(mol)`
Gọi `n_[Fe]=x` ; `n_[Cu]=y`
`=>` $\begin{cases} \dfrac{3}{2}x+y=0,3\\56x+64y=17,2 \end{cases}$
`<=>` $\begin{cases}x=0,05\\y=0,225 \end{cases}$
`@m_[Fe_2(SO_4)_3]=0,025.400=10(g)`
`@m_[CuSO_4]=0,225.160=36(g)`
`@m_[dd H_2 SO_4]=[(0,15+0,45).98]/80 .100=73,5(g)`
Đúng 4
Bình luận (0)
Sửa đề: 80% ---> 98% (80% chưa đặc nên không giải phóng SO2 được)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\end{matrix}\right.\)
\(\rightarrow56a+64b=17,2\left(1\right)\)
PTHH:
\(2Fe+6H_2SO_{4\left(đặc,nóng\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
a------>3a------------------->0,5a--------------->1,5a
\(Cu+2H_2SO_{4\left(đặc,nóng\right)}\rightarrow CuSO_4+SO_2\uparrow+2H_2O\)
b----->2b------------------->b------------->b
\(\rightarrow1,5a+b=\dfrac{6,72}{22,4}=0,3\left(2\right)\)
Từ \(\left(1\right)\left(2\right)\rightarrow\left\{{}\begin{matrix}a=0,05\left(mol\right)\\b=0,225\left(mol\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}m_{Fe_2\left(SO_4\right)_3}=0,5.0,05.400=10\left(g\right)\\m_{CuSO_4}=0,225.160=36\left(g\right)\\m_{ddH_2SO_4}=\dfrac{\left(0,05.3+0,225.2\right).98}{98\%}=60\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
cho m gam hỗn hợp Al và Mg tác dụng với dung dịch H2SO4 đặc nóng. Sau khi các phản ứng xảy ra hoàn toàn thu được dug dịch A chứa 40,2 gam hốn hợp 2 muối sunfat và 7,84 lít khí SO2(đktc, sản phẩm khử duy nhất).Tính m
Chia m gam hỗn hợp gồm 3 kim loại Mg, Al, Cu thành 2 phần bằng nhau: - Phần 1: Cho tác dụng với dung dịch HNO3 đặc, nóng dư thu được 10,528 lít khí NO2 (đktc, là sản phẩm khử duy nhất). - Phần 2: Tác dụng với Cl2 dư thu được 27,875g hỗn hợp muối clorua. Khối lượng m gam hỗn hợp kim loại là A. 22,38 gam B. 20,38 gam C. 11,19 gam D. 10,19 gam
Đọc tiếp
Chia m gam hỗn hợp gồm 3 kim loại Mg, Al, Cu thành 2 phần bằng nhau:
- Phần 1: Cho tác dụng với dung dịch HNO3 đặc, nóng dư thu được 10,528 lít khí NO2 (đktc, là sản phẩm khử duy nhất).
- Phần 2: Tác dụng với Cl2 dư thu được 27,875g hỗn hợp muối clorua.
Khối lượng m gam hỗn hợp kim loại là
A. 22,38 gam
B. 20,38 gam
C. 11,19 gam
D. 10,19 gam
Đáp án : A
P1 : ne trao đổi = nNO2 = 0,47 mol
P2 : ne trao đổi = nCl2 .2 => nCl2 pứ = 0,235 mol
=> mKL = mmuối – mCl2 pứ = 11,19g
=> m = 2.11,19 = 22,38g
Đúng 0
Bình luận (0)
Cho 1,68 gam hỗn hợp A gồm Fe, Cu, Mg tác dụng hết với
H
2
SO
4
đặc, nóng. Sau phản ứng thấy tạo hỗn hợp muối B và khí
SO
2
có thể tích 1,008 lít (đktc). Tính khối lượng muối thu được A. 6,0 gam. B. 5,9 gam. C. 6,5 gam. D. 7,0 gam.
Đọc tiếp
Cho 1,68 gam hỗn hợp A gồm Fe, Cu, Mg tác dụng hết với H 2 SO 4 đặc, nóng. Sau phản ứng thấy tạo hỗn hợp muối B và khí SO 2 có thể tích 1,008 lít (đktc). Tính khối lượng muối thu được
A. 6,0 gam.
B. 5,9 gam.
C. 6,5 gam.
D. 7,0 gam.